INTRODUCCIÓN
Las cardiomiopatías primarias son las enfermedades cardiacas más comunes en gatos. La más frecuente de todas es la cardiomiopatía hipertrófica felina (CMH) que se desarrollará en este artículo. Dicha enfermedad se caracteriza por la disfunción diastólica que se produce como consecuencia de un engrosamiento del miocardio de un ventrículo izquierdo no dilatado debido a trastornos relacionados con el propio músculo cardiaco, en lugar de por procesos secundarios que cursan con hipertrofia ventricular como la estenosis aórtica, el hipertiroidismo, la acromegalia u otras enfermedades de origen no cardiaco (Kittleson, 2005). Los machos están más predispuestos que las hembras y la afección es más frecuente en gatos jóvenes (de 5 meses a 6 años de edad).
¿CUÁL ES LA CAUSA QUE LA PRODUCE?
Actualmente, la causa que provoca esta enfermedad miocárdica felina sigue siendo en gran parte desconocida, y por esta razón se denomina cardiomiopatía hipertrófica primaria. No obstante esta afección es más prevalente en ciertas razas como el Maine Coon, Ragdoll, British Shorthair, Sphynx, Chartreux y Persa. Existe una clara evidencia de que la cardiomiopatía hipertrófica puede ser genética en gatos. De hecho, se han identificado dos mutaciones separadas en la proteína C de unión a la miosina en las razas Maine Coon y Ragdoll con esta enfermedad (CasamianSorrosal et al., 2014) y (Meurs et al., 2007).
FISIOPATOLOGÍA
La CMH puede ser leve, moderada o severa. La forma severa incrementa la rigidez del ventrículo izquierdo por sí misma. Además, el flujo sanguíneo que abastece a un miocardio muy engrosado puede verse comprometido, induciendo isquemia, muerte celular y fibrosis. A su vez, la formación de tejido fibroso en el músculo cardiaco intensifica más la rigidez de la cámara y probablemente es la principal causa de la marcada disfunción diastólica que es vista en esta enfermedad (Kittleson, 2005).
Un ventrículo rígido no puede llenarse de forma adecuada durante la diástole (relajación ventricular), lo cual resulta en un aumento de la presión de llenado diastólica dentro del ventrículo que puede provocar de forma progresiva un aumento de presión de la aurícula izquierda así como de la presión venosa pulmonar dando lugar a un agrandamiento de la aurícula izquierda, edema pulmonar y efusión pleural, respectivamente (Hamlin, 1999). Este aumento de tamaño de la aurícula izquierda deriva en un enlentecimiento sanguíneo que predispone a la aparición de tromboembolismo. La embolización más frecuente suele darse en la trifurcación de la aorta (Soto & Caro, 2011).
Por otro lado, el movimiento sistólico anterior de la válvula mitral es común en gatos diagnosticados con CMH. El velo anterior de esta válvula se desplaza hacia el septo interventricular creando una obstrucción dinámica al flujo sanguíneo de salida por la aorta durante la sístole. La regurgitación mitral que se produce a consecuencia de este hecho puede contribuir al aumento de la presión en el atrio izquierdo (Kittleson, 2005).
¿QUÉ SIGNOS CLÍNICOS PRESENTAN?
Los gatos con CMH pueden ser asintomáticos, por lo que el motivo de consulta suele ser otro. No obstante, se debe sospechar de la enfermedad durante el examen clínico, por ejemplo, al hallar un soplo o sonido de galope a la auscultación. Algunos son llevados al veterinario porque presentan dificultad respiratoria a causa de un edema pulmonar, derrame pleural o ambos. Otros, pueden acudir al veterinario con enfermedad tromboembólica presentando paresia o parálisis de las extremidades posteriores (Kittleson, 2005).
Los signos clínicos son inespecíficos, comunes a otras enfermedades cardiacas y dependen del grado de enfermedad. En la tabla 1 se muestran los signos clínicos que más se presentan en los gatos con cardiomiopatía hipertrófica y su frecuencia de presentación.
|
SIGNOS |
FRECUENCIA DE PRESENTACIÓN |
|
Disnea |
68% |
|
Sonidos de galope |
33% |
|
Soplo sistólico |
31% |
|
Taquicardia |
26% |
|
Paraparesia extremidades posteriores |
11% |
|
Arritmias |
10% |
- Tabla 1: Signos clínicos y su frecuencia. (Fuente: Paige et al., 2009; Payne et al., 2010)
DIAGNÓSTICO
El diagnóstico de esta enfermedad se basa principalmente en el estudio ecocardiográfico, descartando en primer lugar otras causas subyacentes de hipertrofia concéntrica como la estenosis aórtica, la hipertensión arterial sistémica y el hipertiroidismo.
Algunos de los hallazgos que se pueden encontrar durante la ecografía son:
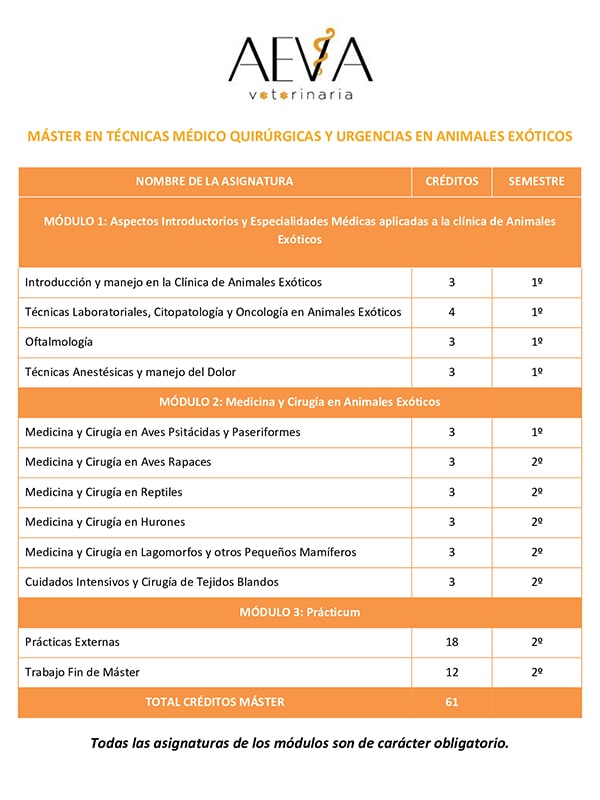
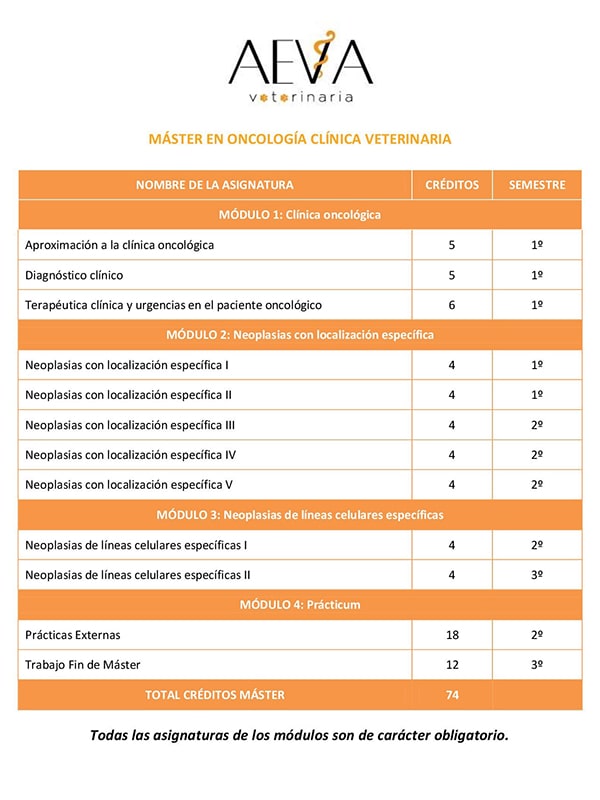
aumento del grosor ventricular a la vez que se puede observar una disminución del tamaño de la luz del ventrículo izquierdo y la dilatación de la aurícula izquierda como se puede apreciar en la figura 1. Es importante evaluar esta dilatación porque los gatos que la presentan están predispuestos a sufrir tromboembolismo. Otros signos ecocardiográficos que se pueden observar son la obstrucción dinámica del flujo sanguíneo de salida del ventrículo izquierdo (ver figura 2) y la regurgitación de la válvula mitral.
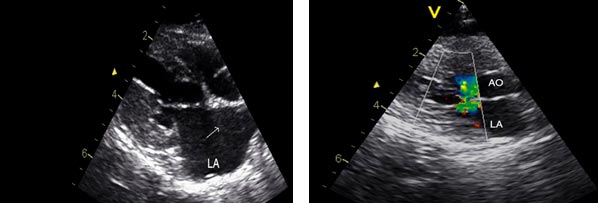
| Figura 1. Ventana paraesternal derecha, eje longitudinal de un gato con CMH. El atrio izquierdo (LA) está muy dilatado. Fuente: (De Madron, 2015). | Figura 2. Ventana paraesternal derecha, eje longitudinal en modo Doppler de un gato con CMH y movimiento anterior de la válvula mitral. Se puede observar un flujo turbulento en el tracto de salida del ventrículo izquierdo Fuente: (De Madron, 2015). |
La valoración de la disfunción diastólica también se puede valorar por ecocardiografía. El grado de disfunción depende del grado de enfermedad. Así, una función diastólica normal evolucionará a una relajación retardada con una presión de llenado normal y más tarde a una relajación anómala con presiones de llenado elevadas. La fracción de acortamiento sirve para estimar la función ventricular que puede estar normal o acrecentada y no es más que la relación entre el diámetro diastólico y el diámetro sistólico del ventrículo izquierdo (De Madron, 2015).
Algunos gatos con cardiomiopatía hipertrófica tienen un electrocardiograma normal aunque incrementos de voltaje en la onda R y una desviación hacia la izquierda del eje cardiaco medio sugieren hipertrofia del ventrículo izquierdo (Häggström et al., 2015).
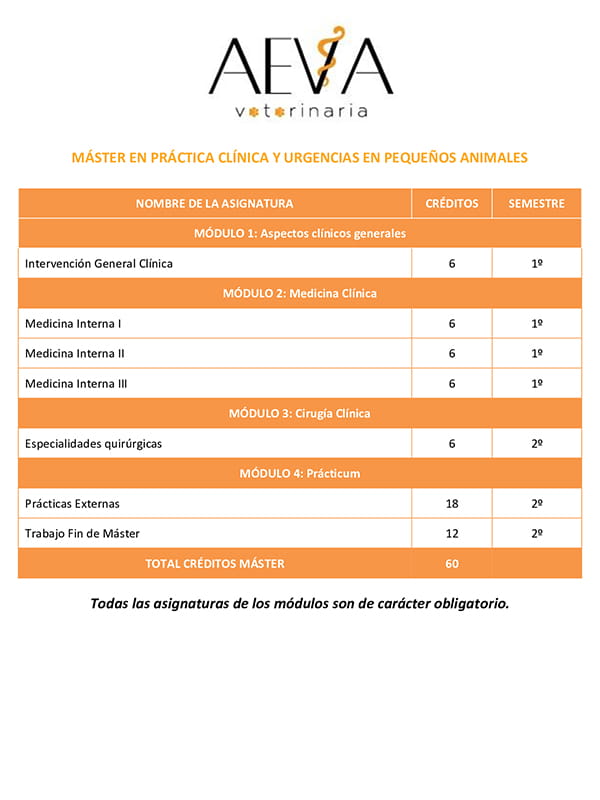
Por su parte, la radiografía no nos permite distinguir de qué tipo de cardiomiopatía se trata. En un gato con CMH la aurícula izquierda puede aparecer dilatada (ver figura 3). El edema pulmonar suele estar presente en casos de insuficiencia cardiaca congestiva, y su distribución es diferente a la de los perros. El derrame pleural también es frecuente (Kittleson, 2005).

Figura 3: Vista lateral del tórax de un gato con CMH y atrio izquierdo dilatado. Fuente (Guglielmini & Diana, 2014)
TRATAMIENTO
El tratamiento está orientado en mejorar el rendimiento diastólico, tratar la insuficiencia cardiaca congestiva y prevenir la presentación de tromboembolismo.
- Insuficiencia cardiaca aguda: es muy importante minimizar el estrés antes de realizar cualquier prueba diagnóstica. En general, se comienza con la sedación utilizando butorfanol (0.05 -0,30 mg/kg IV, IM o SC pero normalmente se administra a 0,1 mg/kg) o buprenorfina (0,005-0,02 mg/kg IV, IM o SC) junto con oxígeno y terapia de furosemida (2-4 mg/kg, IV o IM para casos muy descompensados o 12mg/kg para pacientes menos descompensados). También se pueden emplear vasodilatadores como la pomada de nitroglicerina al 2% aplicada tópicamente, aunque su efecto terapéutico no está claro. En algunos casos, puede estar indicado repetir bolos de furosemida o instaurar una infusión continua de la misma. Si hay grandes cantidades de efusión pleural, se deberá realizar una toracentesis. Si la insuficiencia cardiaca descompensada es muy severa y hay signos de bajo gasto cardiaco se debe considerar la administración de inotropos positivos como la dobutamina (1-10 mcg/kg/min CRI) junto con la monitorización del electrocardiograma y la presión sanguínea por las posibles taquiarritmias e hipertensión secundarias a este fármaco. El inodilatador pimobendan no está registrado para su uso en gatos, sin embargo se ha incrementado la utilización del mismo en aquellos que presentan fallo cardiaco. A pesar de la ausencia de evidencia científica, muchos gatos con fallo cardiaco reciben aspirina o clopidogrel como terapia profiláctica antiplaquetaria (Ferasin & Defrancesco, 2015).
- Insuficiencia cardiaca crónica: cuando el animal ha sido controlado y está estable, se intenta administrar furosemida a la menor dosis efectiva posible en mg/kg/día. El propietario puede cooperar en casa monitorizando la frecuencia respiratoria del animal. Para compensar los efectos potenciales renina-angiotensinaaldosterona de la furosemida se recurre a inhibidores de la enzima convertidora de angiotensina (IECAs) cuando el paciente está estable y comiendo. Se emplea el enalaprilo o benzaceprilo a 0,5 mg/kg vía oral cada 24 horas, Hay autores que usan Bbloqueantes como el atenolol. Se recomienda comenzar con dosis bajas (6,25 mg/gato/12 h vía oral) una vez los signos de congestión se hayan corregido. La administración de pimobendan se podría recomendar en combinación con el resto de tratamientos en casos de fallo cardiaco crónico caracterizado por disfunción sistólica y sin obstrucción del flujo de salida del ventrículo izquierdo. Otros lo utilizan en situaciones críticas cuando el tratamiento no funciona y como última opción (Gordon & Cote, 2015).
BIBLIOGRAFÍA
Casamian-Sorrosal, D., Chong, S. K., Fonfara, S., y Helps, C. (2014). Prevalence and demographics of the MYBPC3-mutations in ragdolls and Maine coons in the British Isles. The Journal of small animal practice, 55 (5), 269-273.
De Madron, E. (2015). Evaluation of Feline Cardiomyopathies. En: De Madron,
E., Chetboul., Bussadori, C (Eds). Clinical Echocardiography of the Dog and Cat (pp
208-225). St Louis, United States. Elsevier Masson
Ferasin, L., y Defrancesco, T. (2015). Management of acute heart failure in cats. Journal of Veterinary Cardiology, 17 (1), S173-S189.
Fox, P. R., Oyama, M. A., Reynolds, C., Rush, J. E., DeFrancesco, T. C.,
Keene, B. W., Atkins, C. E., Macdonald, K. A., Schober, K. E., Bonagura, J. D.,
Stepien, R. L., Kellihan, H. B., Nguyenba, T. P., Lehmkuhl, L.B., Lefbom, B. K., Moise, N.S., y Hogan, D. F. (2009). Utility of plasma N-terminal pro-brain natriuretic peptide (NT-proBNP) to distinguish between congestive heart failure and non-cardiac causes of acute dyspnea in cats. Journal of Veterinary Cardiology, 11 (1), S51-61.
Gordon, S. G., y Cote, E. (2015). Pharmacotherapy of feline cardiomyopathy: Chronic management of heart failure. Journal of Veterinary Cardiology, 17 (1), S159172.
Guglielmini, C., y Alessia, D. (2015). .Thoracic radiography in the cat:
identification of cardiomegaly and congestive heart failure. Journal of Veterinary Cardiology, 17 (1), S87-S101.
Häggström, J., Luis Fuentes, V., y Wess, G. (2015). Screening for hypertrophic cardiomyopathy in cats. Journal of Veterinary Cardiology, 17 (1), S134- S149.
Hamlin, R.L. (1999). Pathophysiology of the failing heart. En: Fox, P. R., Sisson, D., y Moise, N.S. (Eds), Textbook of Canine and Feline Cadiology: Principles and Practice (pp. 205-215). Philadelphia, United States. WB Saunders.
Humm, K., Hezzell, M., Sargent, J., Connolly, D. J., Boswood, A. (2013). Differentiating between feline pleural effusions of cardiac and non-cardiac origin using pleural fluid NT-proBNP concentrations. The Journal of small animal practice; 54 (12), 656-661.
Kittleson, D. M. (2005). Feline Myocardial Disease. En: Ettinger, J. S., y Edward, C. F. (Eds), Textbook of Veterinary Internal Medicine: Diseases of the Dog and Cat (pp. 1082-1103). Philadelphia, United States: Elsevier.
Meurs, K. M., Norgard, M. M., Ederer, M. M., Hendrix, K. P., y Kittleson, M.D. (2007). A substitution mutation in the myosin binding protein C gene in ragdoll hypertrophic cardiomyopathy. Genomics, 90 (2), 261-264.
Paige, C.; Abbott, J.; Elvinger, F.; y Payle, R. (2009). Prevalence of cardiomyopathy in apparently healthy cats. J. Am. Vet. Med. Assoc, 234 (11), 13981403.
Payne, J.; Fuentes, L.; Boswood,A.; Connolly, H.; Koffas, H.; y Brodbelt, D .(2010). Population characteristics and survival in 127 referred cats with hypertrophic cardiomyopathy (1997 to 2005). J. Small. Anim. Pract, 51 (10), 540-547.
Soto, A., y Caro, A. (2011). Urgencias cardiacas. En: Fragío, C (Ed). Manual de Urgencias en Pequeños animales (pp 261- 288). Barcelona, España. Multimédica Ediciones Veterinarias.